Un aspecto muy importante a la par que descuidado de la observación microscópica, es obtener una iluminación apropiada de la muestra.
Para las fotografías que realizo para nuestra web he utilizado la llamada iluminación de Köhler, con ella obtenemos una iluminación apropiada que nos permite obtener la mayor cantidad de detalles de cada preparación.
Aunque no es difícil de conseguir, hay que tener cierto dominio de las diferentes partes de un microscopio óptico. Ya vimos en nuestro post que las podíamos clasificar en:
- Sistema mecánico que permite el enfoque de la muestra.
- Sistema óptico en forma de un conjunto de diversas lentes que permiten la ampliación.
- Sistema de iluminación formado por un emisor de luz y un conjunto de elementos que reflejan y conducen dicha luz hasta la muestra además de un regulador de la intensidad luminosa.
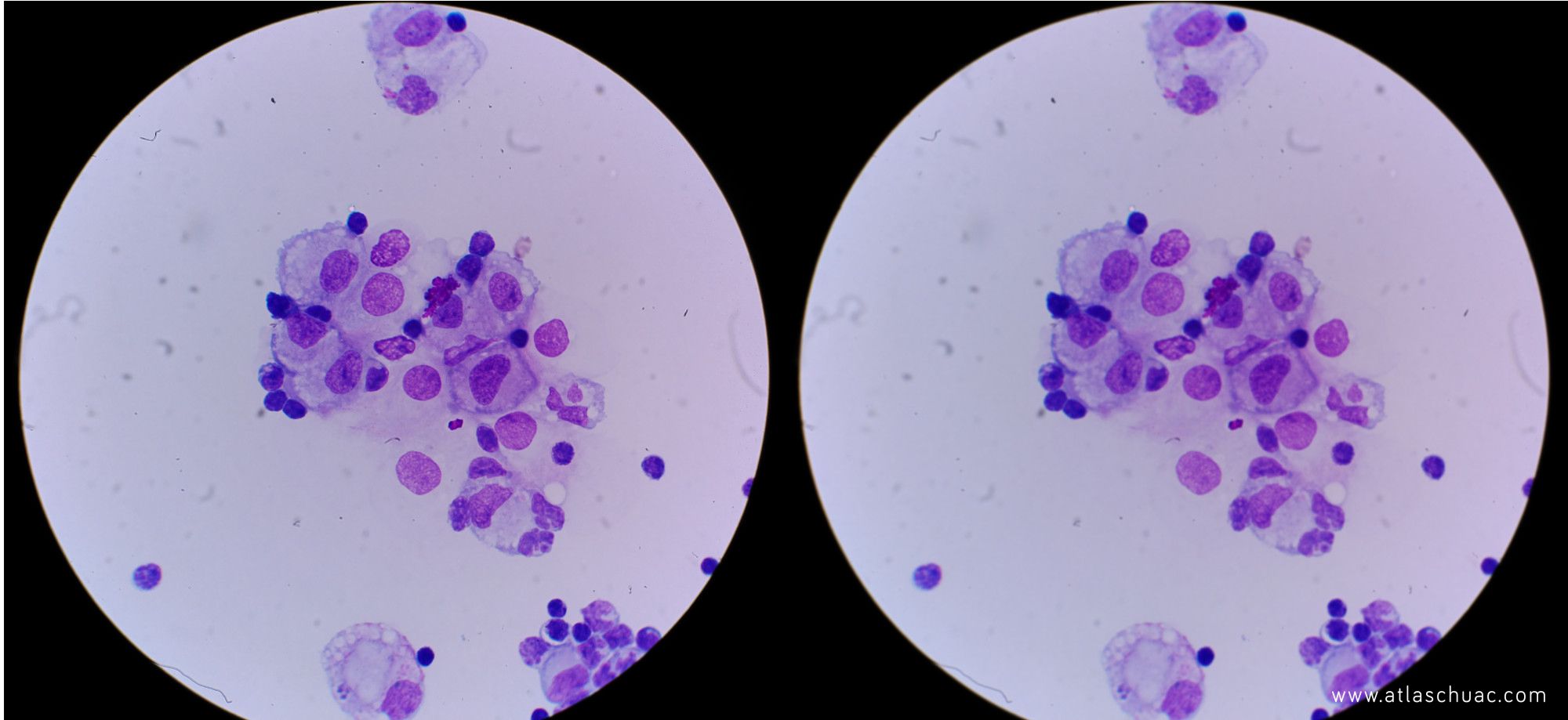
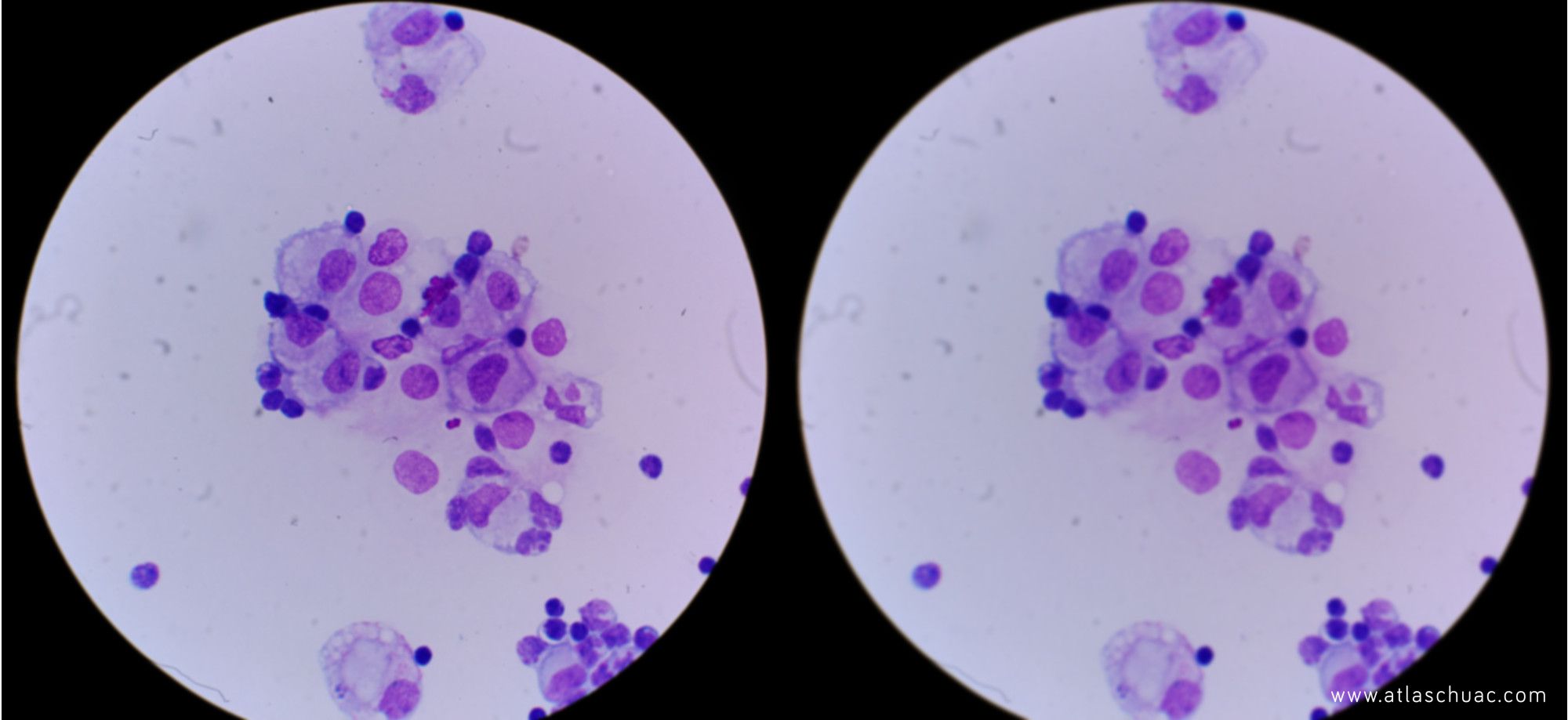
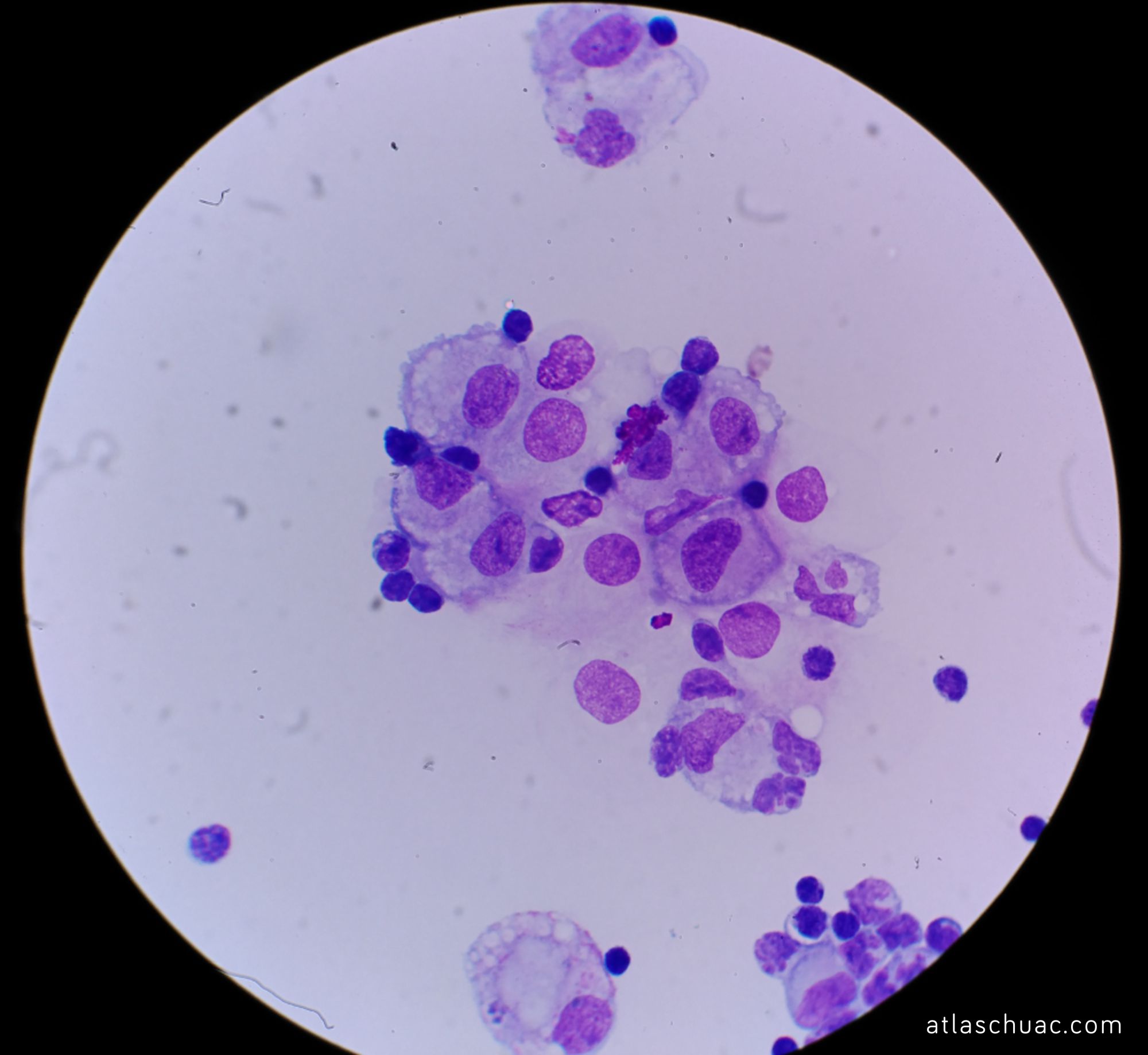
Hemos de tener en cuenta que en la iluminación van a intervenir varios factores. por un lado tendremos el contraste (ver fotografía 1) y la resolución, y por otro la intensidad luminosa (ver fotografía 2).

Fotografía 1 – Modificación de la imagen inicial del post, con disminución (izquierda) y aumento del contraste (derecha).
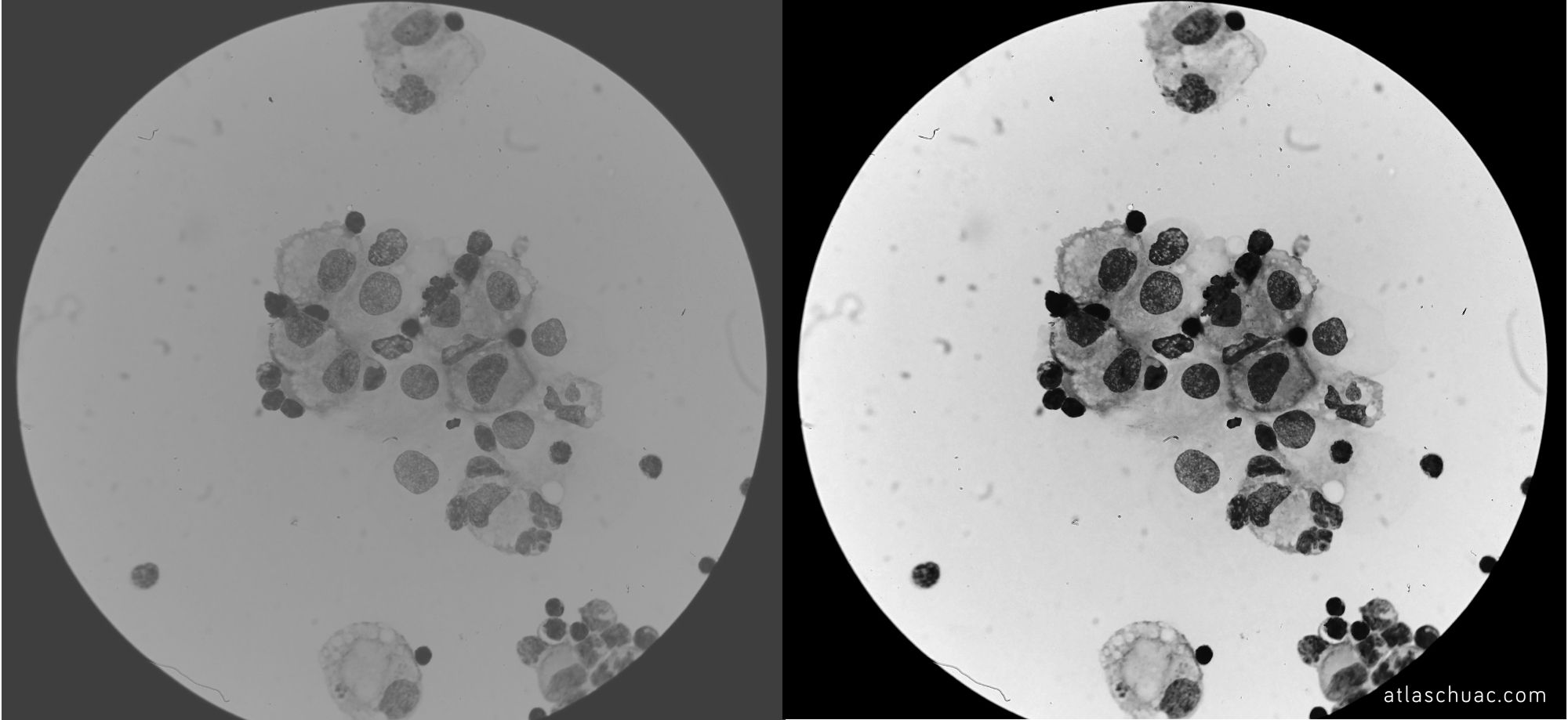
Misma imagen que en la fotografía previa pero convertida a escala de grises; se aprecia mejor la diferencia de contrastes.
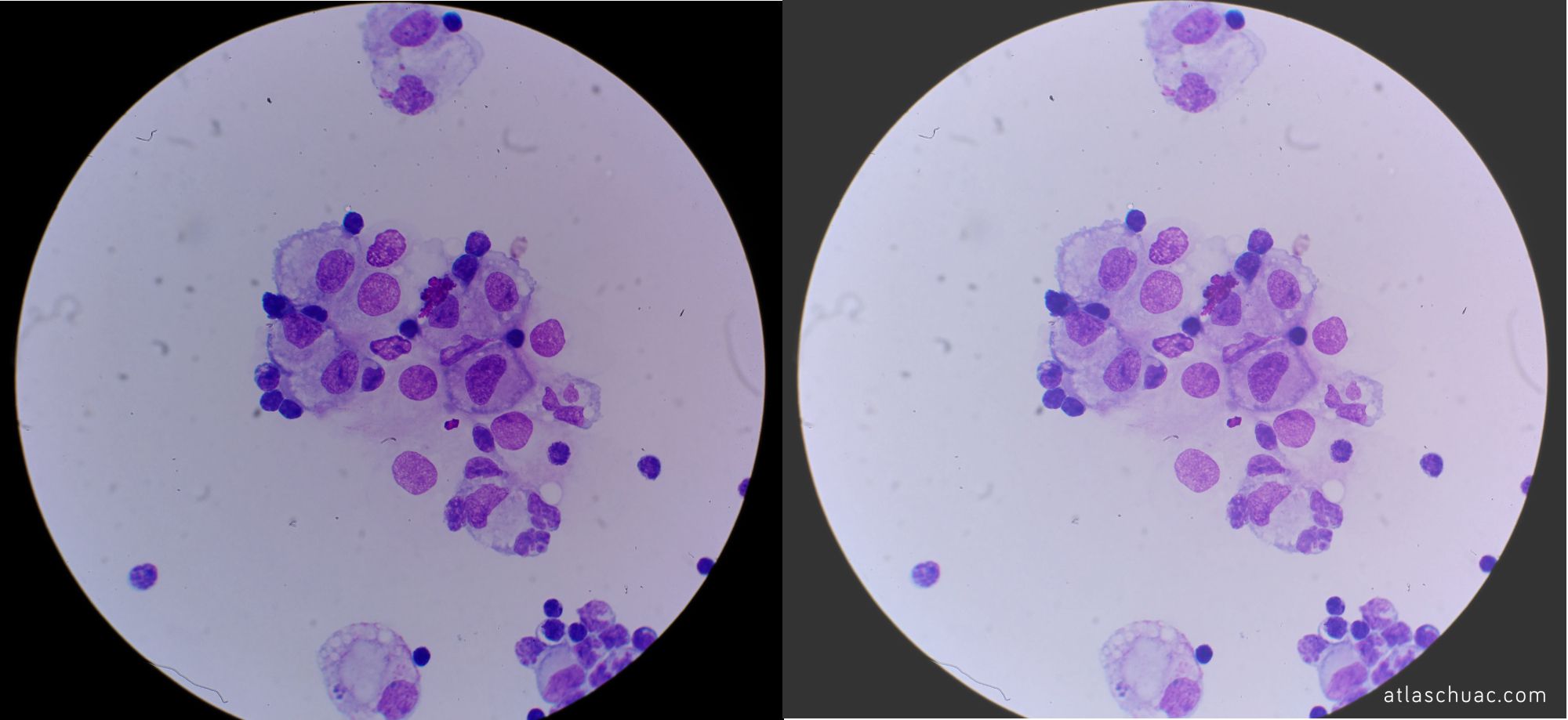
Fotografía 2 – Modificación de la imagen inicial donde solo se ha modificado el brillo de la misma. Disminuido a la izquierda y aumentado a la derecha.
Ahora bien, ¿cómo utilizamos esto para conseguir una buena iluminación?
- Enfocamos la muestra como se explicó en el post previo.
- Cerramos ambos diafragmas y, si el condensador no está ajustado, se observará un círculo luminoso de bordes poco definidos.
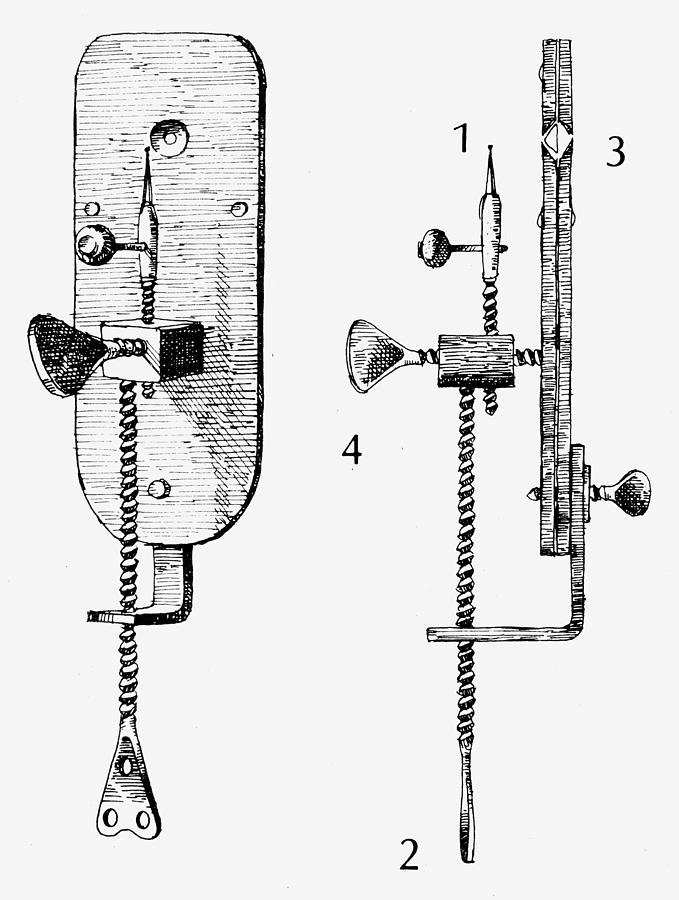
- Hay que tener en cuenta que si ese círculo no aparece en el centro hemos de centrar el condensador (fotografía 3). Para ello usaremos los tornillos que aparecen en la fotografía 4. Lo usual es aflojar el que fija el condensador y usar los otros dos tornillos para mover el círculo luminoso hasta el centro. Una vez allí volvemos a apretar el tornillo de fijación.
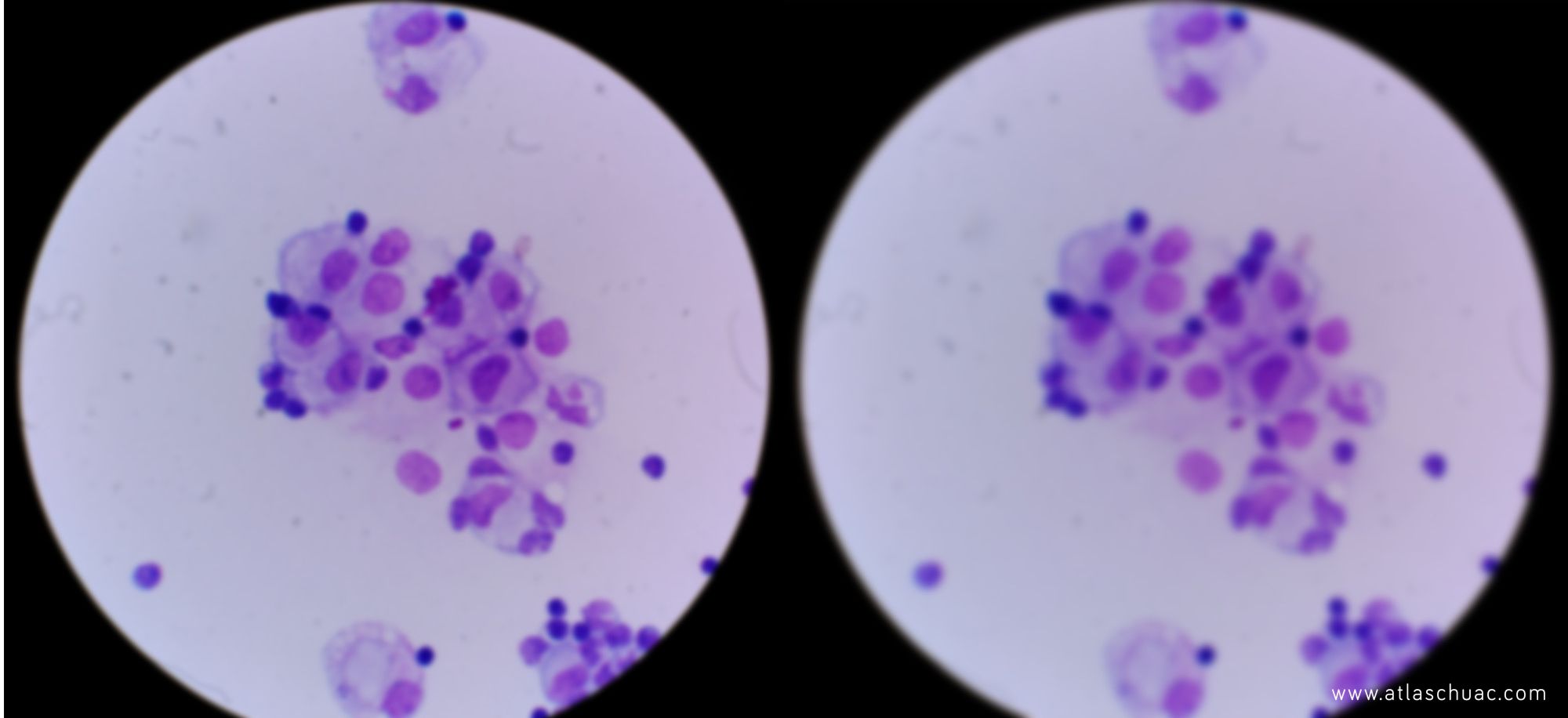
- Ahora hemos de ajustar la altura del condensador hasta conseguir que el círculo se convierta en un polígono de lados bien definidos (fotografía 5).

Fotografía 3 – Proceso de centrado del condensador.

Fotografía 4 – Se señalan algunos componentes del microscopio, entre ellos los tornillos para centrado del condensador.

Fotografía 5 – Proceso de ajuste de la altura del condensador. Aunque no se ve con claridad en la foto, a la derecha se puede intuir que el círculo difuminado ha pasado a tener bordes más bien poligonales.
Ahora ajustaremos ambos diafragmas para conseguir que la muestra esté iluminada de forma regular. Esto va a variar según el objetivo empleado, por lo que se describe a continuación tendrá que ser repetido cada vez que cambiemos de uno a otro.
Seguiremos dos pasos:
- Usaremos el diafragma de campo para iluminar solamente la parte de la muestra que estamos observando. Si partimos de que lo teníamos cerrado, lo abrimos lentamente. Veremos como la porción iluminada (que tendrá borde hexagonal) se hace mayor. Hemos de detenernos cuando pasemos ligeramente el borde del campo observado (fotografía 6).
- Ajustamos el diafragma del condensador para obtener la mejor relación contraste/resolución, pudiendo hacerlo de dos formas diferentes:
- Una posibilidad es quitar uno de los oculares y observar el círculo luminoso que hay (fotografía 7). Abriremos el diafragma del condensador hasta que dicho círculo ocupe un 60-70% del total.
- La otra implica abrirlo mientras observamos la muestra y obtener la relación contraste/resolución “a ojo” según lo que estemos observando.
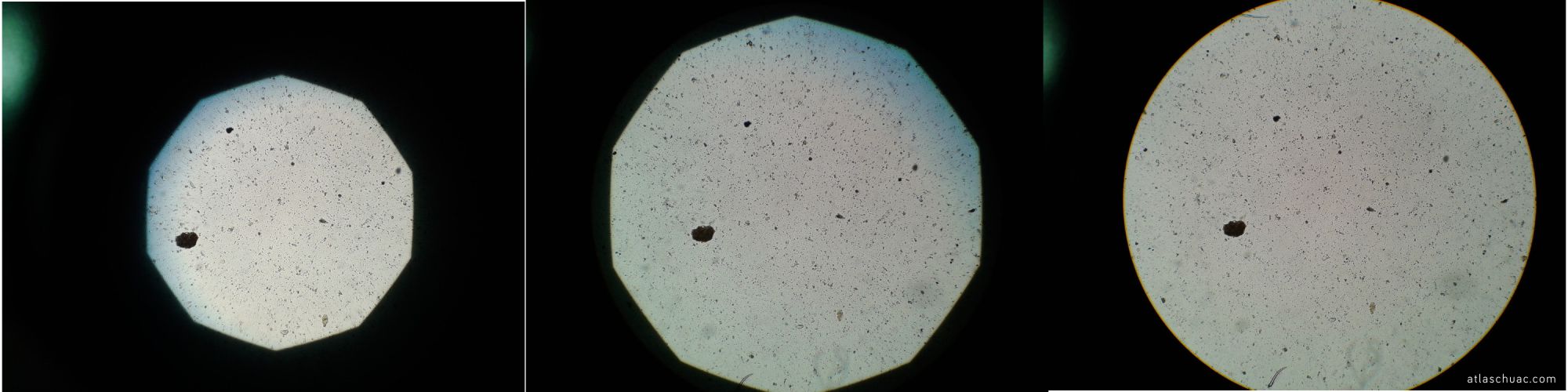
Fotografía 6 – Ajuste de la apertura del diafragma de campo. Como el condensador está a la altura correcta se aprecia la forma poligonal del diafragma de campo. Lo abriremos hasta que ocupe todo el campo de observación.

Fotografía 7 – Ajuste de la apertura del diafragma del condensador: En la fotografía de la izquierda se aprecia cómo retiramos el ocular que no tiene ajuste de dioptrías. En la fotografía derecha se aprecia que en su lugar aparece un círculo luminoso, abriremos el diafragma hasta que ocupe un 60-70% del total.
Para acabar ajustamos la intensidad luminosa con su rueda correspondiente (fotografía 8).

Fotografía 8 – Se señalan algunos elementos del microscopio, entre ellos la rueda de ajuste de intensidad luminosa.
Y esto es todo. Si nos acostumbramos a realizar estos ajustes, con un poco de práctica se interiorizan con rapidez y nos facilitan la observación. Si aún queda alguna duda recomiendo echar un vistazo a este tutorial en la web de Leica o a vídeos en Youtube.
Jaime Ollero Gómez. R3 Bioquímica Clínica. CHUAC
Fotos realizadas en el laboratorio de Análisis Clínicos del CHUAC.